Kiến thức về pphản ứng trung hòa là một trong những chủ đề trọng tâm của chương trình hóa học thcs. Trong bài viết dưới đây, chúng ta hãy cùng nhau tìm hiểu sâu hơn về các chủ đề trên nhé!
Biết thế nào là phản ứng trung hòa?
Định nghĩa trung hòa
Phản ứng trung hòa là phản ứng giữa axit và bazơ, sau phản ứng dung dịch thu được (gồm muối và nước) không còn tính axit hay kiềm, tức là số mol axit = số mol của cơ sở. .
Điều kiện trung hòa
- Phản ứng trung hòa là phản ứng trao đổi nên điều kiện của phản ứng trung hòa cũng là điều kiện của phản ứng trao đổi
- Phản ứng trao đổi trong dung dịch của một chất chỉ có thể xảy ra nếu sản phẩm là chất không tan hoặc khí hoặc nước.
- Đầu tiên cần nhấn mạnh rằng nếu bắt đầu phản ứng trung hòa với lượng axit và bazơ bằng nhau (theo số mol) thì khi kết thúc phản ứng chỉ thu được một muối duy nhất, nghĩa là không Axit hoặc bazơ dư.
- Ngoài ra, một tính chất rất quan trọng của phản ứng axit-bazơ là giá trị pH, giá trị này cho biết mức độ axit hoặc bazơ của dung dịch. Điều này được xác định bởi số lượng ion h+ được tìm thấy trong dung dịch được đo.
- Mặt khác, độ axit và độ kiềm có nhiều khái niệm khác nhau tùy thuộc vào các thông số được xem xét. Một khái niệm nổi bật là của Bronsted và Lowry, những người coi axit là chất cho proton (h+) và bazơ nhận proton.
- Nếu t <;1 thì chỉ xảy ra phản ứng (2) và có thể dư h2so4
- Nếu t > 2 thì chỉ có phản hồi (1) và có thể thừa.
- Nếu 1 <; t < 2 thì xảy ra phản ứng (1) và (2) như trên.
- Tính nồng độ mol của mỗi axit trong a.
- 200ml dung dịch a phản ứng được với bao nhiêu ml dung dịch bazơ b chứa đúng 0,2m và tri(oh)2 0,1m.
- Tính tổng khối lượng muối thu được sau phản ứng của 2 dung dịch a và b.
Ví dụ về phản ứng trung hòa
cuso4+ 2naoh→ na2so4+ cu(oh)2
k2so4+ nah: Không có phản ứng xảy ra.
Hiệu ứng nhiệt trung hòa
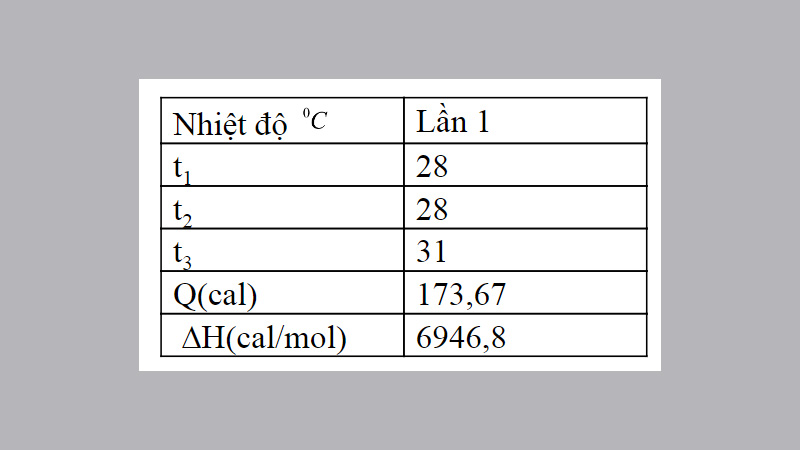
Thí nghiệm: Xác định hiệu ứng nhiệt của phản ứng trung hòa giữa nacl và naoh
Nếu t1≠t2 thì t là hiệu giữa t3 và (t1+t2)/2
Ta có:
q= (m0c0+mhclchcl+mnaclcnacl) (t3-(t1+t2)/2)
q= (7,89+25+25)(31-(28+28)/ 2)= 173,67cal
Nguyên lý phản ứng trung hòa
Phân loại phản ứng trung hòa
Axit mạnh + bazơ mạnh
Lấy phản ứng của một axit sunfuric nhất định và kali hydroxit trong môi trường nước làm ví dụ, theo phương trình sau:
h2so4+ 2koh→ k2so4+ 2h2o
Có thể thấy, cả axit và hiđroxit đều là chất điện ly mạnh nên chúng bị ion hóa hoàn toàn trong dung dịch. Độ pH của dung dịch này sẽ phụ thuộc vào tỷ lệ lớn hơn của chất điện ly mạnh hơn.
Axit mạnh + bazơ yếu
hno3+ nh3→ nh4no3
Trong trường hợp này, nước do muối tạo ra không được quan sát thấy vì nó phải được biểu thị như sau:
hno3+ nh+4+ ồ−→ nh4no3+ h2o
Vì vậy, có thể thấy rằng nước là sản phẩm của phản ứng. Trong trường hợp này, độ pH kiềm của dung dịch có tính axit.
Axit yếu + bazơ mạnh
ch3cooh+ nah→ch3coona+ h2o
Vì axit axetic là chất điện ly yếu nên nó sẽ phân ly một phần để tạo thành natri axetat và nước, làm cho dung dịch có tính kiềm.
Axit yếu + bazơ yếu
Cuối cùng, như đã nói ở trên, bazơ yếu không trung hòa được axit yếu. Điều ngược lại không xảy ra. Cả hai chất đều thủy phân trong dung dịch nước và độ pH của dung dịch phụ thuộc vào “độ ổn định” của axit và bazơ.
Ví dụ về phản ứng trung hòa
Ví dụ kinh điển về trung hòa là phản ứng của axit và bazơ để tạo thành muối và nước: axit + bazơ → muối + nước
hcl+ nah→ nacl+ h2o
Mũi tên phải biểu thị phản ứng hoàn toàn với sự hình thành sản phẩm. Trong khi ví dụ cổ điển là hợp lệ, một biểu thức tổng quát hơn dựa trên lý thuyết axit-bazơ của brosted-lowry là: ah+ b→ a+ bh
Một số ví dụ phổ biến về phản ứng trung hòa:
ca(oh)2+h2so4→ caso4+ 2h2o
6hcl+ co2→ caco3+ h2o
cu(oh)2+h2so4→ cuso4+ 2h2o
hcl+ koh→ kcl+ h2o
ca(hco3)2+ h2so4→ 2h2o+ 2co2+ caso4
Một số bài tập trung hòa
Lý thuyết cần nhớ
Axit đơn: hcl, hbr, hi, hno3. Ta có nh=naxit
Polyaxit: h2so4, h3po4, h2so3. Ta có nh= 2nacid hoặc nh= 3nacid
Thông tin cơ bản đơn giản: koh, naoh, lioh. Chúng tôi có noh=nbazo
Polybase: ba(oh)2,ca(oh)2. Ta có noh= 2nbazo
pthh của quá trình trung hòa: h++oh−→ h2o
Phương pháp giải
Bước 1: Viết ra những gì xảy ra.
Bước 2: Nếu có nhiều vấn đề khác nhau, hãy đặt vấn đề không xác định.
Bước 3: Lập phương trình toán học
Bước 4: Giải phương trình toán học để tìm ẩn.
Bước 5: Tính toán theo yêu cầu của khóa học
Lưu ý:
Khi hỗn hợp axit và bazơ phản ứng với hỗn hợp axit, hãy sử dụng công thức tương đương của axit và bazơ.
Đặt thể tích dung dịch cần tìm là v (lít)
Tìm v và ghi nhớ: nhx=nmoh
Câu hỏi cụ thể
Cho từ từ dung dịch h2so4 vào dung dịch nah thì xảy ra phản ứng:
Ưu tiên phản ứng tạo ra muối trung hòa trước
h2so4+ 2naoh→ na2so4+ h2o (1)
Khi số mol h2so4 = số mol thì phản ứng xảy ra
h2so4+ nah→ nahso4+ h2o (2)
Cách giải: xét tỉ lệ mol và viết các pthh xảy ra.
Cho t=nnaoh/nh2so4
Thay vào đó:
Cho từ từ dung dịch nah vào dung dịch h2so4 thì xảy ra phản ứng:
Phản ứng ưu tiên đầu tiên tạo ra muối có tính axit.
h2so4+ nah→ nahso4+ h2o (1)
Sau đó
naohdu+nahso4→na2so4+h2o
Ví dụ: một dung dịch chứa hcl và h2so4, tỉ lệ mol là 3:1, giả sử 100ml dung dịch đó trung hoà bởi 50ml dung dịch naoh chứa 20g nah/lít.
Giải pháp
Theo đề bài ta có:
nhcl/nh2so4=1/3
Gọi x là số mol h2so4 thì số mol hcl gấp 3 lần
Số mol có trong 1 lít dung dịch là:
nnaoh=20/ 40=0,5
Nồng độ mol/lít của dung dịch là:
cm(nah)=0.5/ 1=0.5m
Số mol đã dùng cho phản ứng trung hòa là:
nnaoh=0.05.0.5=0.025mol
pthh đã xảy ra:
Phương trình hóa học của phản ứng trung hòa
Từ pthh (1) và (2) ta có:
3x + 2x = 0,025
⇔ 5x = 0,025
⇔x = 0,005
Vì vậy:
nh2so4=x= 0,005 mol
nhcl= 3x= 3.0.005=0.015 mol
Nồng độ của chất trong dung dịch a là:
cm(h2so4)= 0,005/ 0,1= 0,05 m
cm(hcl)= 0,015/ 0,1= 0,15 m
Gọi ha là axit đại diện cho 2 axit đã cho. 200 ml dung dịch a chứa:
nha= nhcl+ 2nh2so4= 0,015.0,2+ 0,05.0,2.2=0,05mol
Gọi moh là bazơ đặc trưng và v (lít) là thể tích dung dịch b chứa 2 bazơ đã cho:
nmoh= nnaoh+ 2nba(oh)2= 0,2v+ 2.0,1v= 0,4v
Phương trình phản ứng trung hòa:
ha+ moh→ ma+ h2o (3)
Theo phương trình phản ứng ta có:
nmoh= nha= 0,05mol
Vì vậy:
0,4v=0,05v=0,125L=125ml
Theo kết quả câu b, ta có:
nnaoh=0,125.0.2=0,025mol
nba(oh)2=0.125.0.1=0.0125mol
nhcl=0.2.0.015=0.03mol
nh2so4=0,2.0,05=0,01mol
Vì phản ứng trên là phản ứng trung hòa, các chất tham gia phản ứng đều hoạt động nên dù phản ứng nào xảy ra trước thì tính chất của muối cuối cùng vẫn không thay đổi hoặc bảo toàn.
mm= mso4+ mna+ mba+ mcl
= 0,01.96 + 0,025.23 + 0,0125.137 + 0,03.35,5
= 0,96 + 1,065 + 0,575 + 1,7125 = 4,3125 gam
dinhnghia.com.vn đã tổng hợp những kiến thức hữu ích về chủ đề pPhản ứng trung hòa trong bài viết trên. Chúng tôi hy vọng bạn đã tìm thấy thông tin cần thiết về chủ đề phản ứng trung hòa. Chúc may mắn với các nghiên cứu của bạn!
Xem video của giáo viên Fan Yushan để biết chi tiết: